Bài tập nhận biết hóa chất
BÀI TẬP NHẬN BIẾT
* Nguyên tắc:
- Phải dùng các phản ứng xảy ra nhanh, hiện tượng rõ ràng (kết tủa, sủi bọt khí, thay đổi màu dung dịch, .) để nhận biết.
- Nếu có dung dịch axit, dung dịch bazơ (được dùng quì tím) thì phải dùng quì tím để nhận biết dd axit, dd bazơ trước.
- Nếu dùng chất A để nhận biết chất B thì ngược lại ta có thể dùng chất B để nhận biết chất A.
- Nếu đề bài giới hạn thuốc thử, sau khi dùng thuốc thử trong giới hạn nhận biết được chất A thì ta có thể dùng chất A làm thuốc thử để nhận biết các chất khác.
- Nếu đề bài không cho dùng thuốc thử thì phải lập bảng trộn các dung dịch với nhau để nhận biết.
- Nếu đề yêu cầu nhận biết các chất rắn, thường ta phải dùng nước thử tính tan chúng để chia chúng ra làm 2 nhóm: nhóm tan được trong nước và nhóm không tan trong nước, sau đó nhận biết tiếp.
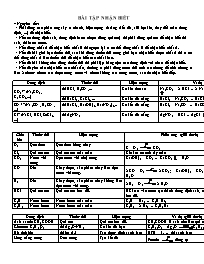
BÀI TẬP NHẬN BIẾT * Nguyên tắc: - Phải dùng các phản ứng xảy ra nhanh, hiện tượng rõ ràng (kết tủa, sủi bọt khí, thay đổi màu dung dịch, ...) để nhận biết. - Nếu có dung dịch axit, dung dịch bazơ (được dùng quì tím) thì phải dùng quì tím để nhận biết dd axit, dd bazơ trước. - Nếu dùng chất A để nhận biết chất B thì ngược lại ta có thể dùng chất B để nhận biết chất A. - Nếu đề bài giới hạn thuốc thử, sau khi dùng thuốc thử trong giới hạn nhận biết được chất A thì ta có thể dùng chất A làm thuốc thử để nhận biết các chất khác. - Nếu đề bài không cho dùng thuốc thử thì phải lập bảng trộn các dung dịch với nhau để nhận biết. - Nếu đề yêu cầu nhận biết các chất rắn, thường ta phải dùng nước thử tính tan chúng để chia chúng ra làm 2 nhóm: nhóm tan được trong nước và nhóm không tan trong nước, sau đó nhận biết tiếp. Dung dịch Thuốc thử Hiện tượng Ví dụ Chú ý CO32– (Na2CO3, K2CO3,...) dd HCl, H2SO4,... Có khí thoát ra Na2CO3 + 2 HCl → 2 NaCl + H2O + CO2 SO32– dd BaCl2, CaCl2, ... Có kết tủa trắng BaCl2 + Na2CO3 → BaCO3 + 2 NaCl SO32–; SO42– SO42– (Na2SO4, H2SO4, ...) dd BaCl2, Ba(OH)2, Ba(NO3)2,.. Có kết tủa trắng BaCl2 + Na2SO4 → BaSO4 + 2 NaCl SO32–; CO32– Cl– (NaCl, HCl, ZnCl2, ...) dd AgNO3 Có kết tủa trắng AgNO3 + HCl → AgCl + HNO3 SO42–, CO32–, ... Chất khí Thuốc thử Hiện tượng Phản ứng (giải thích) Chú ý O2 Que đóm Que đóm bùng cháy C + O2 CO2 Cl2 Quì tím ướt Quì tím ướt mất màu Clo ẩm có tính tẩy màu CO2 Nước vôi trong Đục nước vôi (dư) trong Ca(OH)2 + CO2 → CaCO3 + H2O SO2 CO Đốt Cháy được, sản phẩm cháy làm đục nước vôi trong. 2 CO + O2 2 CO2; Ca(OH)2 + CO2 → CaCO3 + H2O H2 Đốt Cháy được, sản phẩm cháy không làm đục nước vôi trong. 2 H2 + O2 2 H2O CO, CH4, C2H4, C2H2, ... HCl Quì tím ướt Quì tím ướt hóa đỏ. HCl tan vào nước tạo thành dung dịch axit, nên làm quì tím hóa đỏ. HBr C2H4 Nước brom Nước brom mất màu C2H4 + Br2 → C2H4Br2 C2H2 C2H2 Nước brom Nước brom mất màu C2H2 + 2 Br2 → C2H2Br4 C2H4 Dung dịch Thuốc thử Hiện tượng Ví dụ (giải thích) Chú ý Axit axetic CH3COOH Quì tím Quì tím hóa đỏ. CH3COOH là axit nên làm quì tím hóa đỏ. HCl, H2SO4, ... Glucozơ C6H12O6 dd Ag2O/NH3 Có kết tủa bạc C6H12O6 + Ag2O C6H12O7 + 2 Ag Hồ tinh bột dd iot (I2) Tạo dung dịch xanh lam HTB + I2 → dd xanh lam Lòng trắng trứng Đun nóng Tạo kết tủa Protein đông tụ ** Phân biệt 2 chất lỏng rượu etylic (C2H5OH) và benzen (C6H6) → Dùng kim loại Na, chất lỏng nào phản ứng với Na sủi bọt khí là C2H5OH 2 C2H5OH + 2 Na → 2 C2H5ONa + H2 NHẬN BIẾT MỘT SỐ CHẤT VÔ CƠ 1. Nhận biết NH3 - Dung dịch phenolphtalein: Dung dịch phenolphtalein từ không màu màu tím hồng - Quỳ tím: Làm xanh giấy quỳ tím - Giấy tẩm dung dịch HCl: Có khói trắng xuất hiện NH3 + HCl → NH4Cl (tinh thể muối) - Dung dịch muối Fe2+: Tạo dung dịch có màu trắng xanh do NH3 bị dung dịch muối Fe2+ hấp thụ 2NH3 + Fe2+ + 2H2O → Fe(OH)2 (trắng xanh) + 2NH4+ 2. Nhận biết SO3 - Dung dịch BaCl2: Tạo kết tủa trắng, bền, không phân hủy 3. Nhận biết H2S - Giấy tẩm Pb(NO3)2: Làm đen giấy tẩm H2S + Pb(NO3)2 → PbS↓ + HNO3 4. Nhận biết O3, Cl2 - Dung dịch KI: Làm xanh giấy tẩm hồ tinh bột O3 + 2KI + H2O → 2KOH + O2↑ + I2 Cl2 + 2KI → 2KCl + I2 I2 sau khi sinh ra thì làm xanh giấy tẩm hồ tinh bột 5. Nhận biết SO2 - Dung dịch Br2: Làm nhạt màu đỏ nâu của dung dịch Br2 SO2 + Br2 + 2H2O → H2SO4 + 2HBr - Dung dịch KMnO4: Làm nhạt màu dung dịch thuốc tím 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4 - Dung dịch H2S: Tạo bột màu vàng SO2 + 2H2S → 3S↓ + 2H2O - Dung dịch I2: Nhạt màu vàng của dung dịch I2 SO2 + I2 + 2H2O → H2SO4 + 2HI - Dung dịch Ca(OH)2 dư: Làm cho nước vôi trong bị vẩn đục SO2 + Ca(OH)2 → CaSO3↓ + H2O 6. Nhận biết CO2 - Dung dịch Ca(OH)2 dư: Làm cho nước vôi trong bị vẩn đục CO2 + Ca(OH)2 → CaCO3↓ + H2O 7. Nhận biết CO - Dung dịch PdCl2: Làm vẩn đục dung dịch PdCl2 CO + PdCl2 + H2O → Pd↓ + HCl 8. Nhận biết NO2 - H2O, O2, Cu: NO2 tan tốt trong nước với sự hiện diện của không khí, dung dịch sinh ra hòa tan Cu nhanh chóng 4NO2 + 2H2O + O2 → 4HNO3 8HNO3 + 3Cu → 3Cu(NO3)2 + 2NO↑ + 4H2O 9. Nhận biết NO - Khí O2: Hóa nâu khi gặp O2 2NO + O2 → 2NO2↑ (màu nâu) - Dung dịch muối Fe2+: Bị hấp thụ bởi dung dịch muối Fe2+ tạo phức hợp màu đỏ sẫm Fe2+ + NO → [Fe(NO)]2+ 10. Nhận biết H2, CH4 - Bột CuO nung nóng và dư: - Cháy trong CuO nóng là cho CuO màu đen chuyển sang màu đỏ của Cu H2 + CuO → Cu↓ (màu đỏ) + H2O CH4 + CuO → Cu↓ (màu đỏ) + CO2↑ + H2O Riêng CH4 có tạo ra khí CO2 làm đục nước vôi trong có dư 11. Nhận biết N2, O2 - Dùng tàn đóm que diêm: N2 làm tắt nhanh tàn đóm que diêm O2 làm bùng cháy tàn đóm que diêm thêm một tí nữa nha: chất rắn nhé. Fe(OH)2 màu trắng xanh Fe(OH)3 màu đỏ nâu Ag3PO4 (vàng) Ag2S màu đen I2 rắn màu tím thì fải AgCl, BaSO4, PbCl2, NaHCO3, CaCO3,......... màu trắng dd Br2 có màu da cam hoặc đỏ nâu tùy nồng độ ........................... AgBr vàng nhạt AgI vàng Ag2S đen K2MnO4 : lục thẫm KMnO4 :tím Mn2+: vàng nhạt Zn2+ trắng Al3+: trắng màu của muối sunfua _Đen: CuS ,FeS ,Fe2S3 ,Ag2S ,PbS ,HgS _Hồng: MnS _Nâu: SnS _Trắng: ZnS _Vàng: CdS ------------------ 1 số muối khi đốt thì cháy với các ngọn lửa màu khác nhau K+ ngọn lửa màu tím Na+ thì ngọn lửa màu vàng Ca2+ thì cháy với ngọn lửa màu cam Li Li cho ngọn lửa đỏ Cs ngọn lửa mầu xanh da trời Ba2+ đốt có màu lục vàng ÁP DỤNG: a) Nhận biết bằng thuốc thử không hạn chế: Ví dụ1: Cho các dung dịch sau đây: KOH, K2SO4, KCl, HCl. Hãy nêu phương pháp hóa học nhận biết từng dung dịch. - Nghiên cứu đầu bài:Nhận biết dùng thuốc thử không hạn chế (có thể dùng một hoặc nhiều thuốc thử để nhận biết mỗi dung dịch). -Xác định hướng giải: - Trình bày lời giải: B1: Phân loại chất và tìm thuốc thử + KOH: Kiềm, có thể nhận biết bằng quỳ tím hoặc Phênoltalein. riêng cho từng dung dịch. + K2SO4: Muối trung hòa, có thể dùng thuốc thử BaCl2. + KCl: Muối trung hòa, có thể dùng thuốc thử AgNO3. + HCl: Axit, có thể dùng thuốc thử là quỳ tím hay AgNO3. B2 :Xác định phương pháp nhận biết: Dung dịch Thuốc thử KOH K2SO4 KCl HCl Qùy tím Xanh Quỳ tím Quỳ tím Đỏ BaCl2 _ BaSO4↓Trắng Còn lại _ B3: Nêu cách tiến hành: - Cho một mẫu giấy quỳ tím vào 4 ống nghiệm đựng mỗi chất. Nếu quý tím ngả sang màu xanh đó là KOH, quỳ tím ngả màu đỏ là HCl - Nhỏ 2-3 giọt d d BaCl2 vào 2 ống đựng K2SO4 và KCl. ống nào có kết tủa trắng xuất hiện là K2SO4, ống còn lại là KCl. - Viết PTHH (nếu có): PT: BaCl2 + K2SO4 → BaSO4 ↓ + 2 KCl b) Nhận biết các d d bằng cách không dùng thuốc thử nào khác: Ví dụ 2: Hãy nhận biết các dd sau:CuSO4, NaOH, BaCl2, mà không dùng thuốc thử nào khác. Nghiên cứu đầu bài: + Dùng chính mỗi chất cần nhận biết làm thuốc thử. + Hoặc nhận biết một chất có màu sắc, mùi vị đặc biệt, dùng chất này để nhận biết các chất còn lại. - Xác định hướng giải: - Trình bày lời giải: B1: Tìm d d có dấu hiệu đặc biệt. + D D CuSO4 màu xanh + D D NaOH, BaCl2 không màu. B2: Xác định cách nhận biết: + D D màu xanh là CuSO4 + Dùng d d CuSO4 để nhận biết d d NaOH và BaCl2 T. Thử Chất CuSO4 NaOH Cu(OH)2 ↓ Trắng BaCl2 BaSO4 ↓ Trắng B3: Nêu cách tiến hành: + Quan sát màu sắc:D D màu xanh là CuSO4 + Nhỏ 2-3 giọt CuSO4 vào mỗi ống nghiệm đựng d d NaOH, d d BaCl2,lọ nào có kết tủa xanh NaOH,lọ nào có kết tủa trắng là BaCl2. Viết PTHH (Nếu có) PT: CuSO4 + 2NaOH → CuSO4 ↓ + Na2SO4 BaCl2 + CuSO4 → BaSO4 ↓ + CuCl2 ● Ở bài tập này có thể nhận biết mỗi d d trên theo cách thứ hai là dùng mỗi d d trong đó làm thuốc thử. C) Nhận biết d d với số thuốc thử có hạn chế . Ví dụ 3: Cho các dd sau: CuCl2, H2SO4, Ba(NO3)2, NaOH. Hãy nhận biết mỗi dd mà chỉ dùng giấy quỳ tím. - Nghiên cứu đầu bài: Trường hợp này tương tự trường hợp (b) với cách giải 1 - Xác định hướng giải và trình bày lời giải: B1: Xem xét phản ứng của các dd nhận biết thuốc thử đã cho. T.Thử Chất Qùy tím CuCl2 không H2SO4 Đỏ Ba(NO3)2 Không NaOH Xanh B2: Xác định phương pháp nhận biết : T.Thử Chất NaOH H2SO4 CuCl2 Cu(OH)2 ↓ Không Ba(NO3)2 Không BaSO4 ↓ B3: Nêu cách làm: - Cho một mẫu quỳ tím vào mỗi ống nghiệm. Nếu quỳ tím ngả màu đỏ đó là d d H2SO4, nếu quỳ tím ngả màu xanh đó là NaOH. - Nhỏ 2-3 giọt d d NaOH vào hai ống nghiệm còn lại, nếu có kết tủa xanh đó là CuCl2,còn lại là Ba(NO3)2. Hoặc nhỏ 2-3 giọt H2SO4 vào hai ống nghiệm còn lại, nếu có kết tủa trắng đó là BaCl2, ống kia CuSO4 ▄ Bảng một số hóa chất để nhận biết: Chất Thuốc thử Hiện tượng PTHH Muối sunfat:Na2SO4 BaCl2, Ba(OH)2, Ba(NO3)2 Kết tủa trắng BaSO4 ↓ Na2SO4 + BaCl2→BaSO4 ↓+2NaCl Muối cacbonat:CaCO3 HCl, H2SO4 Sủi bọt CO2↑ CaCO3+ HCl → CaCl2 +H2O +CO2↑ Muối clorua: NaCl AgNO3 Kết tủa trắng AgCl ↓ NaCl +AgNO3 → AgCl ↓ +NaNO3 Axit Qùy tím Đỏ _ Baz ơ Qùy tím phenolphtalein đỏ Xanh _
Tài liệu đính kèm:
 cach nhan biet hoa chat hay.doc
cach nhan biet hoa chat hay.doc





