Đề khảo sát chất lượng học kỳ I môn Hóa học Lớp 9 - Mã đề 01 - Năm học 2011-2012 - Trường THCS Phù Hóa (Có đáp án)
Câu 3: (2.0đ)
a. Sắp xếp các kim loại dưới đây theo chiều giảm dần mức độ hoạt động?
Cu ; H ; Al ; Mg ; Zn ; K .
b. Kim loại nào không phản ứng với dung dịch axit thường?
Kim loại nào không tham gia phản ứng đẩy kim loại trong dung dịch muối?
Bạn đang xem tài liệu "Đề khảo sát chất lượng học kỳ I môn Hóa học Lớp 9 - Mã đề 01 - Năm học 2011-2012 - Trường THCS Phù Hóa (Có đáp án)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
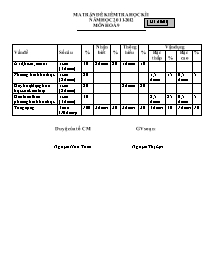
MA TRẬN ĐỀ KIỂM TRA HỌC KÌ I M· ®Ò:01 NĂM HỌC 2011-2012 MÔN HOÁ 9 Vấn đề Số câu % Nhận biết % Thông hiểu % Vận dụng Bậc thấp % Bậc cao % Axit, bazơ, muối 1 câu (3 điểm) 30 2 điểm 20 1điểm 10 Phương trình hoá học 1 câu (2 điểm) 20 1,5 điểm 15 0,5 điểm 5 Dãy hoạt động hoá học của kim loại 1 câu (2 điểm) 20 2điểm 20 Giải toán theo phương trình hoá học 1 câu (3 điểm) 30 2,5 điểm 25 0,5 điểm 5 Tổng cộng 4 câu (10 điểm) 100 2 điểm 20 3điểm 30 4 điểm 40 1điểm 10 Duyệt của tổ CM GV soạn: Nguyễn Hữu Tuấn Nguyễn Thị Lợi TRƯỜNG THCS PHÙ HÓA ĐỀ KSCL HỌC KÌ I NĂM HỌC 2011- 2012 Mã đề:01 Số báo danh: Môn : Hoá học - Lớp 9 Thời gian làm bài 45 phút( không kể thời gian giao đề) ĐỀ RA: Câu 1:( 3.0đ) Có 4 lọ hoá chất bị mất nhãn đựng 4 dung dịch sau: HCl ; KOH ; Ca(NO3)2 ; H2SO4 . Bằng cách nào có thể phân biệt 4 dung dịch trên? Câu 2 (2.0đ) t0 Hoàn thành các phương trình phản ứng sau: a. Fe + ? FeCl3 b. Cu + ? Cu(NO3)2 + Ag c. Al + ? Al2(SO4)3 + SO2 + H2O d ? + Ba(OH)2 BaSO4 + NaOH Câu 3: (2.0đ) a. Sắp xếp các kim loại dưới đây theo chiều giảm dần mức độ hoạt động? Cu ; H ; Al ; Mg ; Zn ; K . b. Kim loại nào không phản ứng với dung dịch axit thường? Kim loại nào không tham gia phản ứng đẩy kim loại trong dung dịch muối? Câu 4: ( 3.0đ) Cho 5,4 gam Al phản ứng hoàn toàn với 200 ml dung dịch HCl thu được muối AlCl3 và khí H2 (đktc). Tính thể tích khí H2 thu được ? Tính nồng độ mol của dung dịch HCl ? ( Biết Al = 27 ; H = 1 ; Cl = 35,5 ) ****************************** Duyệt của tổ CM GV soạn: Nguyễn Hữu Tuấn Nguyễn Thị Lợi TRƯỜNG THCS PHÙ HÓA HƯỚNG DẪN CHẤM KSCL HỌC KÌ II NĂM HỌC 2011- 2012 M· ®Ò:01 M«n : HOÁ HỌC - Lớp 9 Câu 1: (3,0đ) - Trích mẫu thử từ 4 lọ hoá chất ra 4 ống nghiệm. 0.25đ - Cho vào 4 ống nghiệm 1 mẫu giấy quỳ tím: 0.25đ + Hai ống nghiệm làm quỳ tím chuyển sang màu đỏ đó là HCl và H2SO4 .(Nhóm 1) 0.5đ + Một ống nghiệm làm quỳ tím chuyển sang màu xanh đó là KOH. 0.25đ + Một ống nghiệm không làm quỳ tím đổi màu đó là Ca(NO3)2. 0.25đ - Cho vào 2 ống nghiệm ở nhóm 1 vài giọt dung dịch BaCl2 : 0.25đ + Một ống nghiệm có kết tủa trắng là H2SO4. 0.25đ Phương trình phản ứng: H2SO4 + BaCl2 BaSO4 + 2 HCl 0.5đ + Một ống nghiệm không có hiện tượng gì là HCl. 0.25đ - Dán nhãn tên gọi, công thức hoá học vào các lọ ban đầu. 0.25đ t0 Câu 2: (2.0đ) a. 2Fe + 3Cl2 2FeCl3 0.5đ b. Cu + 2 AgNO3 Cu(NO3)2 + 2Ag 0.5đ c. 2Al + 6 H2SO4 đ/nóng Al2(SO4)3 + 3 SO2 + 6 H2O 0.5đ d Na2SO4 + Ba(OH)2 BaSO4 + 2 NaOH 0.5đ (Chú ý chọn 1 chất đúng 0,25 đ, cân bằng đúng1 phương trình 0,25 đ) Câu 3: (2.0đ) a. Dãy kim loại giảm dần mức độ hoạt động: K ; Mg ; Al ; Zn ;H ; Cu . 0.5đ b. - Kim loại không phản ứng với dung dịch axit thường là Cu 0.5đ Vì Cu đứng sau H trong dãy điện hoá. 0.25đ - Kim loại không tham gia phản ứng đẩy kim loại trong dung dịch muối là K. 0.5đ Vì K đứng trước Mg trong dãy điện hoá. 0.25đ Câu 4: (3,0đ) a. Số mol Al : nAl = 5,4/27 = 0,2 mol. 0.25đ Phương trình phản ứng: 2Al + 6HCl 2AlCl3 + 3H2 0.5đ 1mol 3 mol 1mol 1,5mol 0.25đ 0,2 mol 0,6mol 0,2mol 0,3mol 0.5đ 2 Theo phương trình ta có nH = 0,3 mol 0.25đ Thể tích khí H2 : V = 22,4 . 0,3 = 6,72 lít 0.5đ b.Theo phương trình ta có nHCl = 0,6 mol. Đổi 200 ml = 0,2 lít 0.25đ Nồng độ mol của dung dịch HCl là: CM = 0,6/0,2 = 3 M 0.5đ *********************************** Duyệt của tổ CM GV soạn: Nguyễn Hữu Tuấn Nguyễn Thị Lợi
Tài liệu đính kèm:
 de_khao_sat_chat_luong_hoc_ky_i_mon_hoa_hoc_lop_9_ma_de_01_n.doc
de_khao_sat_chat_luong_hoc_ky_i_mon_hoa_hoc_lop_9_ma_de_01_n.doc





