Đề khảo sát chất lượng học kỳ I môn Hóa học Lớp 9 - Mã đề 02 - Năm học 2011-2012 - Trường THCS Phù Hóa (Có đáp án)
Câu 3: (2.0đ)
a. Sắp xếp các kim loại dưới đây theo chiều giảm dần mức độ hoạt động?
Ag ; H; Fe ; Sn ; Na ; Mg
b. Kim loại nào không phản ứng với dung dịch axit thường?
Kim loại nào không tham gia phản ứng đẩy kim loại trong dung dịch muối?
Câu 4: ( 3.0đ)
Cho 3,2 gam Fe2O3 phản ứng hoàn toàn với 200 ml dung dịch HCl thu được muối FeCl3
và H2O .
a. Tính khối lượng FeCl3 thu được ?
b. Tính nồng độ mol của dung dịch HCl ?
Bạn đang xem tài liệu "Đề khảo sát chất lượng học kỳ I môn Hóa học Lớp 9 - Mã đề 02 - Năm học 2011-2012 - Trường THCS Phù Hóa (Có đáp án)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
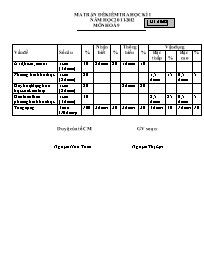
MA TRẬN ĐỀ KIỂM TRA HỌC KÌ I M· ®Ò:02 NĂM HỌC 2011-2012 MÔN HOÁ 9 Vấn đề Số câu % Nhận biết % Thông hiểu % Vận dụng Bậc thấp % Bậc cao % Axit, bazơ, muối 1 câu (3 điểm) 30 2 điểm 20 1điểm 10 Phương trình hoá học 1 câu (2 điểm) 20 1,5 điểm 15 0,5 điểm 5 Dãy hoạt động hoá học của kim loại 1 câu (2 điểm) 20 2điểm 20 Giải toán theo phương trình hoá học 1 câu (3 điểm) 30 2,5 điểm 25 0,5 điểm 5 Tổng cộng 4 câu (10 điểm) 100 2 điểm 20 3điểm 30 4 điểm 40 1điểm 10 Duyệt của tổ CM GV soạn: Nguyễn Hữu Tuấn Nguyễn Thị Lợi TRƯỜNG THCS PHÙ HÓA ĐỀ KSCL HỌC KÌ I NĂM HỌC 2011- 2012 Số báo danh: Mã đề:02 M«n : Hoá học - Lớp 9 Thêi gian lµm bµi 45 phót (kh«ng kÓ thêi gian giao ®Ò) ĐỀ RA Câu 1:( 3.0đ) Có 4 lọ hoá chất bị mất nhãn đựng 4 dung dịch sau: HCl ; KOH ; Ba(OH)2 ; Ca(NO3)2 . Bằng cách nào có thể phân biệt 4 dung dịch trên? Câu 2 (2.0đ) t0 Hoàn thành các phương trình phản ứng sau: a. Fe + O2 ? b. ? + AlCl3 MgCl2 + Al c. Cu + ? CuSO4 + SO2 + H2O d ? + BaCl2 BaSO4 + NaCl Câu 3: (2.0đ) a. Sắp xếp các kim loại dưới đây theo chiều giảm dần mức độ hoạt động? Ag ; H; Fe ; Sn ; Na ; Mg b. Kim loại nào không phản ứng với dung dịch axit thường? Kim loại nào không tham gia phản ứng đẩy kim loại trong dung dịch muối? Câu 4: ( 3.0đ) Cho 3,2 gam Fe2O3 phản ứng hoàn toàn với 200 ml dung dịch HCl thu được muối FeCl3 và H2O . Tính khối lượng FeCl3 thu được ? Tính nồng độ mol của dung dịch HCl ? ( Biết Fe = 56 ; H = 1 ; Cl = 35,5 ; O = 16 ) ****************************** Duyệt của tổ CM GV soạn: Nguyễn Hữu Tuấn Nguyễn Thị Lợi TRƯỜNG THCS PHÙ HÓA HƯỚNG DẪN CHẤM KSCL HỌC KÌ II NĂM HỌC 2011- 2012 M· ®Ò:02 M«n : HOÁ HỌC - Lớp 9 Câu 1: (3,0đ) - Trích mẫu thử từ 4 lọ hoá chất ra 4 ống nghiệm. 0.25đ - Cho vào 4 ống nghiệm 1 mẫu giấy quỳ tím: 0.25đ + Hai ống nghiệm làm quỳ tím chuyển sang màu xanh đó là KOH; Ba(OH)2 (Nhóm 1) 0.5đ + Một ống nghiệm làm quỳ tím chuyển sang màu đỏ đó là HCl. 0.25đ + Một ống nghiệm không làm quỳ tím đổi màu đó là Ca(NO3)2. 0.25đ - Cho vào 2 ống nghiệm ở nhóm 1 vài giọt dung dịch H2SO4: 0.25đ + Một ống nghiệm có kết tủa trắng là. Ba(OH)2 0.25đ Phương trình phản ứng: H2SO4 + Ba(OH)2 BaSO4 + 2 H2O 0.5đ + Một ống nghiệm không có hiện tượng gì là KOH. 0.25đ - Dán nhãn tên gọi, công thức hoá học vào các lọ ban đầu. 0.25đ t0 Câu 2: (2.0đ) a. 3Fe + 2O2 Fe3O4 0.5đ b. 3Mg + 2AlCl3 3MgCl2 + 2 Al 0.5đ c. Cu + 2 H2SO4 đ/nóng CuSO4 + SO2 + 2 H2O 0.5đ d. Na2SO4 + BaCl2 BaSO4 + 2 NaCl 0.5đ (Chú ý chọn 1 chất đúng 0,25 đ, cân bằng đúng1 phương trình 0,25 đ) Câu 3: (2.0đ) a. Dãy kim loại giảm dần mức độ hoạt động: Na; Mg ; Fe ; Sn ;H ; Ag. 0.5đ b.- Kim loại không phản ứng với dung dịch axit thường là Ag. 0.5đ Vì Ag đứng sau H trong dãy điện hoá. 0.25đ - Kim loại không tham gia phản ứng đẩy kim loại trong dung dịch muối là Na. 0.5đ Vì Na đứng trước Mg trong dãy điện hoá. 0.25đ Câu 4: (3,0đ) Fe2O3 a. Số mol Al : n = 3,2/160 = 0,02 mol. 0.25đ Phương trình phản ứng: Fe2O3 + 6HCl 2FeCl3 + 3H2O 0.5đ 1mol 6 mol 2mol 3mol 0.25đ 0,02 mol 0,12mol 0,04mol 0,06mol 0.5đ 3 Theo phương trình ta có nFeCl = 0,04 mol 0.25đ Khối lượng muối FeCl3 là: m = 162,5 . 0,04 = 6,5 g 0.5đ b.Theo phương trình ta có nHCl = 0,12 mol. Đổi 200 ml = 0,2 lít 0.25đ Nồng độ mol của dung dịch HCl là: CM = 0,12/0,2 = 0,6 M 0.5đ *********************************** Duyệt của tổ CM GV soạn: Nguyễn Hữu Tuấn Nguyễn Thị Lợi
Tài liệu đính kèm:
 de_khao_sat_chat_luong_hoc_ky_i_mon_hoa_hoc_lop_9_ma_de_02_n.doc
de_khao_sat_chat_luong_hoc_ky_i_mon_hoa_hoc_lop_9_ma_de_02_n.doc





